
Dr. Antonio Pérez-Martínez
Profesor de Pediatría de la Universidad Autónoma de Madrid. Jefe del grupo de investigación en cáncer infantil de la unidad de investigación clínica IdiPAZ-CNIO. Jefe del Servicio de Hemato-Oncología Pediátrica del Hospital Universitario La Paz.
En Medicina, cambiar el rumbo no es fácil. Las nuevas ideas suelen enfrentarse a años de escepticismo, y muchas veces quedan sepultadas y relegadas al olvido. Pero hoy, hablar de terapia celular como “medicamentos vivos” ya no es una novedad: es una realidad que está transformando la forma en que tratamos enfermedades graves, como los cánceres de la sangre, y muy especialmente en niños.
Este avance no habría sido posible sin el trabajo silencioso y constante de investigadores y médicos científicos que dedicaron su vida a entender el universo de los cánceres infantiles. Aunque no todos son conocidos por el gran público, su legado es inmenso. Gracias a ellos, enfermedades como la leucemia aguda infantil, que hace apenas unas décadas incurable, hoy representa algunos de los mayores logros de la historia médica.
Los pioneros del cambio
Todo comenzó a mediados del siglo XX con Sidney Farber, quien logró las primeras remisiones transitorias en leucemia linfoblástica aguda infantil gracias a la aminopterina, un precursor del metotrexato, citostático habitual para el tratamiento del cáncer en la actualidad. Farber fue pionero además en involucrar a la sociedad, medios de comunicación y figuras públicas para recaudar fondos y concienciar sobre el cáncer infantil. Así nació la Fundación Jimmy, impulsada por uno de sus pacientes, Einar Gustafson, fue clave en la creación del primer centro de investigación en cáncer infantil: el Dana-Farber Cancer Institute en Boston.
Posteriormente, Donald Pinkel, desde el Hospital St. Jude, desarrolló la “terapia total”, una estrategia de poliquimioterapia que mejoró los resultados de Farber y permitió curaciones definitivas en muchos pacientes, poniendo las bases en sus sucesivos estudios “Total” de las bases del tratamiento actual de la leucemia linfoblástica aguda. Este fue el comienzo de la era de la quimioterapia y St. Jude se convirtió en un referente mundial en cáncer pediátrico.

El nacimiento de la terapia celular
Mientras la quimioterapia seguía siendo el pilar del tratamiento para muchos cánceres hematológicos, algo empezaba a cambiar. Se gestaba un giro de timón: algunos tipos de leucemia podrían curarse con una estrategia completamente distinta. Ese gran paso llegó con el Dr. Donald Thomas, quien, pese a resultados iniciales poco prometedores, logró consolidar el trasplante de médula ósea como una opción curativa para leucemias de alto riesgo. Su trabajo fue tan trascendental que en 1990 recibió el Premio Nobel de Medicina.
Este avance abrió una nueva puerta en la comprensión del sistema inmunitario. Se descubrió que ciertas células del injerto, como los linfocitos T y las células Natural Killer (NK), no solo ayudaban, sino que tenían un poder terapéutico comparable al de la quimioterapia. Eso sí, también podían provocar efectos adversos, como la enfermedad del injerto contra el receptor, una complicación muy grave, pero que también revelaba el potencial de estas células para atacar el cáncer.
Así fue como, a principios del siglo XXI, primero en Alemania con el equipo del Dr. Rupert Handgretinger, y luego en Estados Unidos con el Dr. Wing Leung en el hospital St. Jude, se desarrolló el trasplante haploidéntico: una técnica que permite utilizar donantes familiares no completamente compatibles. Esta innovación transformó el trasplante en una auténtica terapia celular personalizada. El legado del Dr. Thomas seguía vivo, y el antiguo trasplante de médula ósea evolucionaba hacia lo que hoy reconocemos como la primera gran terapia celular.
En España, el Hospital Infantil Niño Jesús de Madrid, con los doctores Luis Madero y Miguel Ángel Díaz al frente, fue uno de los primeros en adoptar y liderar esta transformación. Su trabajo marcó un antes y un después en el tratamiento del cáncer infantil en nuestro país.
La evolución de la terapia celular, una revolución con nombre propio, la terapia CAR-T
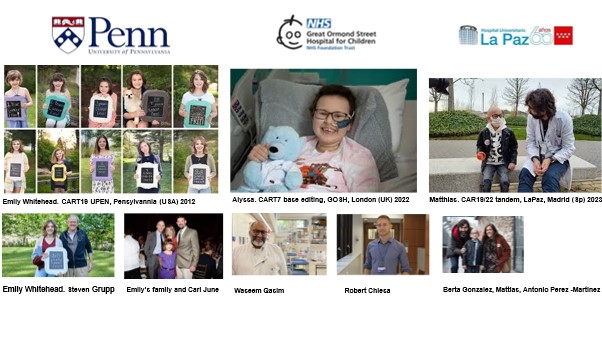
Y de aquellos barros, estos lodos. En 2012, en el Hospital de la Universidad de Pensilvania, una niña llamada Emily Whitehead, diagnosticada con leucemia linfoblástica aguda tipo B resistente, se convirtió en la primera paciente en recibir una terapia celular revolucionaria: sus propios linfocitos T modificados genéticamente mediante el innovador concepto de ingeniería sintética, lo que hoy conocemos como terapia CAR-T. El tratamiento fue desarrollado por el Dr. Stephen Grupp, basado en las investigaciones del inmunólogo Carl June y del profesor Zelig Eshhar, pioneros en este campo. Emily no solo sobrevivió, sino que también fue la primera en experimentar uno de los efectos secundarios más conocidos de esta terapia: el síndrome de liberación de citocinas, una reacción inflamatoria intensa que, aunque peligrosa, es también una señal de que el tratamiento está funcionando. La Fundación Emily Whitehead está ayudando al desarrollo de estas terapias innovadoras en el mundo.
En nuestro país, la Dra. Susana Rives fue la primera en administrar esta terapia en el Hospital Sant Joan de Déu de Barcelona, dentro del ensayo clínico internacional ELIANA, que más tarde llevó a la aprobación del medicamento Kymriah, el primer CAR-T autorizado en Europa.
Paralelamente, el Dr. Manel Juan, en el Hospital Clínic de Barcelona, impulsó un enfoque innovador: la producción local de CAR-T, las células Ari, en honor a una paciente pediátrica, desarrollando el concepto del modelo español o modelo descentralizado “point of care”. Esta estrategia permite fabricar la terapia en el propio hospital, acercándola al paciente y equilibrando el desarrollo comercial con el académico, lo que abre nuevas posibilidades para una medicina más personalizada y accesible sin comprometer la sostenibilidad de los sistemas públicos de salud.
Nuevas fronteras
En mayo de 2022, Alyssa, una adolescente británica, hizo historia al convertirse en la primera paciente del mundo en recibir células T alogénicas editadas genéticamente mediante una técnica llamada “edición de bases”. Su diagnóstico: una leucemia linfoblástica aguda tipo T, resistente a todos los tratamientos previos. Se ampliaba por tanto la diana de las terapias CART, ya no solo eran hemopatías B expresando CD19 sino también patologías de células T expresando CD7.
A diferencia de otras terapias CAR-T, en las que se utilizan los propios linfocitos del paciente, en el caso de Alyssa se emplearon células T de un donante anónimo, previamente modificadas para: a) reconocer y atacar las células leucémicas; b) no generar enfermedad injerto contra receptor en el paciente, ser resistentes al tratamiento linfoablativo y no ser rechazadas por el sistema inmunitario del paciente. La principal ventaja de los CART alogénicos es su inmediatez, sin necesidad de esperar semanas para su fabricación. El tratamiento fue llevado a cabo en el Hospital Great Ormond Street de Londres, por el inmunólogo Waseem Qasim y el hemato-oncólogo Robert Chiesa. Durante el curso 2024-2025 he tenido el privilegio de participar en este ensayo clínico dentro del grupo TvT BE-CAR y comprobar como Alyssa sigue tres años después libre de enfermedad. Los resultados de este ensayo clínico se publicarán a finales de 2025.
En Madrid, siguiendo las investigaciones del Dr. Persis Amrolia con su estudio CARPALL, un CART con dos dominios extracelulares o dos cuellos y dos cabezas, bicistronico 19/22 (Hospital Great Ormond Street), Mattias fue el primer paciente en recibir un CAR-T en tándem (19 y 22), un cuello con dos cabezas, “in house”, diseñado para tratar una leucemia linfoblástica aguda B extramedular resistente incluso a Kymriah. Esta terapia, desarrollada localmente en el Hospital Universitario La Paz, por la Dra. Isabel Mirones, y administrada por la Dra. Berta Gonzalez dentro de nuestro equipo, fue administrada en un contexto de un programa de uso compasivo en el que participaron hasta once pacientes. Este esfuerzo ha dado lugar al ensayo clínico REALCART NCT06709469, que representa un paso más hacia el desarrollo de los CART de nueva generación, como son aquellos con reconocimiento multidiana, una terapia CART aún más personalizada, accesible y adaptada a las necesidades de los pacientes más complejos, incluso aquellos que no responden a Kymriah, y a la vez sostenible.
Un futuro esperanzador
La historia de la terapia celular en oncología pediátrica es una historia de perseverancia, innovación y humanidad. Gracias a estos avances, hoy podemos mirar al futuro con esperanza, sabiendo que lo que antes parecía imposible, ahora es parte de la realidad médica. Sin embargo, no todos son buenas noticias. A pesar de que la terapia CAR-T ha supuesto una revolución en el tratamiento los tumores hematológicos tipo B, su aplicación en tumores sólidos —tumores cerebrales, sarcomas y otros— sigue siendo uno de los grandes desafíos de la oncologia actual.
Aunque ya sabemos que esta terapia es posible y segura en tumores sólidos, su eficacia está aún lejos de la que ha demostrado en tumores de la sangre. ¿Por qué esta falta de eficacia? Existen varias limitaciones como las: a) dificultades para llegar al tumor, el “traficking” y el “homing”: las células CAR-T deben atravesar estructuras complejas como el endotelio, la matriz extracelular o los fibroblastos, que actúan como muros de defensa del tumor; b) pérdida de eficacia: una vez que las células CAR-T alcanzan su objetivo, su capacidad de persistir y funcionar se ve comprometida; c) heterogeneidad del tumor: los tumores sólidos expresan múltiples antígenos, lo que dificulta que una única diana sea efectiva para todos las células tumorales.
¿Qué se está haciendo para superar estos retos?
La comunidad científica está explorando nuevas estrategias para adaptar la terapia CAR-T a este nuevo escenario. En primer lugar, proponer mejores modelos preclínicos, para que reflejen mejor cómo se comportan estas terapias en humanos. Utilizar algunos tipos especifico de linfocitos T como los linfocitos T efectores e infundirlos múltiples veces para garantizar persistencia y función. También, el desarrollo de CAR-T basados en ARN mensajero, que podrían expandirse directamente en el paciente y mejorar la persistencia, y por último generación de “vacunas” que activen las células CAR-T dentro del paciente. Además, se están diseñando ensayos clínicos innovadores con células CAR-T de memoria alogénicas con dianas múltiples, como el ensayo CAR4SAR NCT06087341 para sarcomas avanzados, que se está llevando a cabo en el Hospital Universitario La Paz con el apoyo de la Fundación CRIS contra el Cáncer. Hasta ahora, ya se han reclutado cinco pacientes.
Más allá del cáncer: los CAR-T en enfermedades autoinmunes
Sin embargo, la historia de los CAR-T no se detiene en la oncología. Esta tecnología está empezando a aplicarse en enfermedades inmunomediadas como el lupus eritematoso sistémico, la esclerosis múltiple, la diabetes tipo 1 o la dermatomiositis infantil. La terapia CART permite resetear el sistema inmunológico de forma profunda, evitando la inmunosupresión y sus efectos adversos e induciendo remisiones completas en pacientes graves y refractarios a los tratamientos convencionales. Nuestro grupo, liderado por la Dra. Rosa Alcobendas y el Dr. Andrés París, ha publicado recientemente resultados prometedores en este campo.
Todo esto confirma que la terapia CAR-T no solo está cambiando la forma en que tratamos el cáncer, sino también la manera en que entendemos y modulamos el sistema inmunológico. Nos encontramos ante una de las herramientas más potentes y versátiles de la medicina moderna: la terapia celular, la terapia celular avanzada, los nuevos medicamentos vivos.

Bibliografía
- FARBER S, DIAMOND LK. Temporary remissions in acute leukemia in children produced by folic acid antagonist, 4-aminopteroyl-glutamic acid. N Engl J Med. 1948 Jun 3;238(23):787-93. doi: 10.1056/NEJM194806032382301. PMID: 18860765.
- Pinkel D. Total therapy of acute lymphocytic leukemia. JAMA. 1972 Nov 27;222(9):1170. PMID: 4507724.
- Downing JR, Pui CH. Donald P. Pinkel: In Memoriam (1926–2022). Blood Cancer Discov. 2022 Jul 6;3(4):267–9. doi: 10.1158/2643-3230.BCD-22-0051. Epub 2022 May 11. PMCID: PMC9257425.
- THOMAS ED, LOCHTE HL Jr, LU WC, FERREBEE JW. Intravenous infusion of bone marrow in patients receiving radiation and chemotherapy. N Engl J Med. 1957 Sep 12;257(11):491-6. doi: 10.1056/NEJM195709122571102. PMID: 13464965.
- Hamblin TJ. E. Donnall Thomas, M.D. Nobel laureate 1990. Leuk Res. 1991;15(2-3):71. doi: 10.1016/0145-2126(91)90085-8. PMID: 2016908.
- Granot N, Storb R. History of hematopoietic cell transplantation: challenges and progress. Haematologica. 2020 Dec 1;105(12):2716-2729. doi: 10.3324/haematol.2019.245688. PMID: 33054108; PMCID: PMC7716373.
- Handgretinger R, Lang P. The history and future prospective of haplo-identical stem cell transplantation. Cytotherapy. 2008;10(5):443-51. doi: 10.1080/14653240802251507. PMID: 18615344.
- Leung W. Use of NK cell activity in cure by transplant. Br J Haematol. 2011 Oct;155(1):14-29. doi: 10.1111/j.1365-2141.2011.08823.x. Epub 2011 Aug 4. PMID: 21812770.
- Mamcarz E, Madden R, Qudeimat A, Srinivasan A, Talleur A, Sharma A, Suliman A, Maron G, Sunkara A, Kang G, Leung W, Gottschalk S, Triplett BM. Improved survival rate in T-cell depleted haploidentical hematopoietic cell transplantation over the last 15 years at a single institution. Bone Marrow Transplant. 2020 May;55(5):929-938. doi: 10.1038/s41409-019-0750-7. Epub 2019 Nov 18. PMID: 31740766; PMCID: PMC7202974.
- Pérez-Martínez A, Ferreras C, Pascual A, Gonzalez-Vicent M, Alonso L, Badell I, Fernández Navarro JM, Regueiro A, Plaza M, Pérez Hurtado JM, Benito A, Beléndez C, Couselo JM, Fuster JL, Díaz-Almirón M, Bueno D, Mozo Y, Marsal J, Gómez López A, Sisinni L, de Heredia CD, Díaz MÁ. Haploidentical transplantation in high-risk pediatric leukemia: A retrospective comparative analysis on behalf of the Spanish working Group for bone marrow transplantation in children (GETMON) and the Spanish Grupo for hematopoietic transplantation (GETH). Am J Hematol. 2020 Jan;95(1):28-37. doi: 10.1002/ajh.25661. Epub 2019 Nov 5. PMID: 31625177.
- Maude SL, Laetsch TW, Buechner J, Rives S, Boyer M, Bittencourt H, Bader P, Verneris MR, Stefanski HE, Myers GD, Qayed M, De Moerloose B, Hiramatsu H, Schlis K, Davis KL, Martin PL, Nemecek ER, Yanik GA, Peters C, Baruchel A, Boissel N, Mechinaud F, Balduzzi A, Krueger J, June CH, Levine BL, Wood P, Taran T, Leung M, Mueller KT, Zhang Y, Sen K, Lebwohl D, Pulsipher MA, Grupp SA. Tisagenlecleucel in Children and Young Adults with B-Cell Lymphoblastic Leukemia. N Engl J Med. 2018 Feb 1;378(5):439-448. doi: 10.1056/NEJMoa1709866. PMID: 29385370; PMCID: PMC5996391.
- Martínez-Cibrián N, Ortiz-Maldonado V, Español-Rego M, Blázquez A, Cid J, Lozano M, Magnano L, Giné E, Correa JG, Mozas P, Rodríguez-Lobato LG, Rivero A, Montoro-Lorite M, Ayora P, Navarro S, Alserawan L, González-Navarro EA, Castellà M, Sánchez-Castañón M, Cabezón R, Benítez-Ribas D, Setoaín X, Rodríguez S, Brillembourg H, Varea S, Olesti E, Guillén E, Sáez-Peñataro J, de Larrea CF, López-Guillermo A, Pascal M, Urbano-Ispizua Á, Juan M, Delgado J. The academic point-of-care anti-CD19 chimeric antigen receptor T-cell product varnimcabtagene autoleucel (ARI-0001 cells) shows efficacy and safety in the treatment of relapsed/refractory B-cell non-Hodgkin lymphoma. Br J Haematol. 2024 Feb;204(2):525-533. doi: 10.1111/bjh.19170. Epub 2023 Oct 31. PMID: 37905734.
- Chiesa R, Georgiadis C, Syed F, Zhan H, Etuk A, Gkazi SA, Preece R, Ottaviano G, Braybrook T, Chu J, Kubat A, Adams S, Thomas R, Gilmour K, O’Connor D, Vora A, Qasim W; Base-Edited CAR T Group. Base-Edited CAR7 T Cells for Relapsed T-Cell Acute Lymphoblastic Leukemia. N Engl J Med. 2023 Sep 7;389(10):899-910. doi: 10.1056/NEJMoa2300709. Epub 2023 Jun 14. PMID: 37314354.
- París-Muñoz A, Alcobendas-Rueda RM, Verdú-Sánchez C, Udaondo C, Galán-Gómez V, González-Martínez B, Menéndez JJ, Martínez-Romera I, Minguillón J, Pertíñez L, de Manuel-Gómez C, de la Cruz-Benito A, Sanz-Rupérez A, Remesal A, Cámara C, Sánchez-Zapardiel E, Del Pino-Molina L, Gómez-Zamora A, Serrano-Olmedo MG, Español-Rego M, Ruiz de Valbuena M, Climent F, Dorao P, Ríos-Blanco JJ, Andrade JD, Ruiz-Zurita G, Fernández-García MA, Pérez-Martínez A. CD19 CAR-T cell therapy in a pediatric patient with MDA5+dermatomyositis and rapidly progressive interstitial lung disease. Med. 2025 Apr 25:100676. doi: 10.1016/j.medj.2025.100676. Epub ahead of print. PMID: 40306284.
 Newsletter
Newsletter Contacto
Contacto



